LASER. Light Amplification by Stimulated Emission of Radiation. Um feixe de luz altamente organizado, capaz de interagir com a matéria de inúmeras formas e apresentando uma enorme variedade de aplicações em medicina, indústria, tecnologia, pesquisa científica, telecomunicações… Desde sua 1ª descrição em 1959 por Gordon Gould, o laser modificou a história humana.1
Em medicina, a oftalmologia é uma das especialidades em que esta tecnologia é mais bem aproveitada. Cirurgia refrativa, cirurgia de catarata, capsulotomias, iridectomias, fotocoagulação, fotoestimulação… as aplicações são vastas. Neste artigo iremos conversar sobre seu papel no tratamento das doenças retinianas e como ele evoluiu desde suas descrições iniciais até hoje.
Fotocoagulação a laser
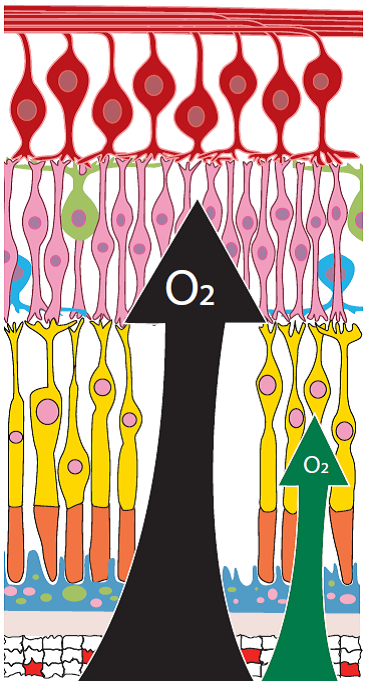
Sabidamente, a hipóxia (falta de oxigênio) desempenha um papel importante na fisiopatogenia das doenças isquêmicas retinianas como a retinopatia diabética, oclusões venosas, retinopatia da prematuridade, vasculites oclusivas entre outras, caracterizadas por uma obstrução dos vasos sanguíneos retinianos e consequente redução de fluxo sanguíneo e oxigênio para a retina. A isquemia resultante estimula a produção de citocinas como o fator de crescimento endotelial vascular (VEGF), resultando em neovascularização e/ou edema macular.2
A fotocoagulação clássica consiste na aplicação de feixes de energia luminosa na forma de laser sobre a retina, onde é convertida em energia térmica, produzindo uma queimadura branco-acinzentada na retina. O objetivo primário visa a uma destruição seletiva (fotoablação) deste tecido isquêmico, geralmente a periferia retiniana, assim restabelecendo-se o balanço entre a oferta e demanda de oxigênio, entre outros mecanismos (Figura 1).
Os estudos pioneiros Diabetic Retinopathy Study (DRS)3 e Early Treatment Diabetic Retinopathy Study (ETDRS)4 publicados em meados dos anos 80, definiram as estratégias do tratamento da retinopatia diabética de acordo com a sua classificação, bem como as técnicas de fotocoagulação recomendadas, após observarem redução de 50% no risco de perda visual e cegueira nos olhos tratados com laser, ao longo de mais de 5 anos de observação. Outros estudos semelhantes também demonstraram de maneira incontestável o benefício do tratamento nas oclusões venosas retinianas (central ou de ramo), retinopatia da prematuridade e, por extensão, outras doenças que tenham como substrato comum a isquemia retiniana. Neste sentido, o laser continua sendo uma ferramenta útil, valiosa e extremamente custo-efetiva no tratamento dessas condições bastante comuns na prática clínica e também no combate à cegueira.5,6
Entretanto, em medicina os tratamentos raramente são isentos de problemas e efeitos colaterais. No caso da fotocoagulação tradicional observamos:
• dor e/ou desconforto intenso por parte do paciente durante a aplicação do laser;
• piora ou descompensação do edema macular, tração vitreorretiniana, hemorragia vítrea e descolamento de retina tracional, muitas vezes precipitando a indicação de vitrectomia;
• perda de campo visual periférico ou danos à visão central (quando realizados próximos à mácula);
• membranas epirretinianas, atrofia óptica tardia, entre outras.
Estes problemas motivaram a indústria e pesquisadores a buscarem melhorias no tratamento, o que foi possível com os avanços tecnológicos. Além do advento do tratamento farmacológico, novos sistemas de laser foram desenvolvidos. Métodos de aplicação semiautomatizados – reduzindo a quantidade de energia dissipada nos tecidos –, melhora das fibras ópticas, portabilidade dos aparelhos,[RL1] [RP2] popularização de comprimentos de onda alternativos e mais seguros, melhor compreensão dos mecanismos de ação, entre outras inovações.
“Primeiro, não causar dano”. Aprimorando o tratamento a laser.
Primum non nocere. Baseado no princípio hipocrático, estudos modernos concluíram que não era necessário destruir o tecido retiniano para se obter o efeito terapêutico. Assim, popularizaram-se os sistemas de laser por padrões, ou multidisparos.7,8 Estes aparelhos funcionam com uma variedade de padrões pré-definidos semelhantes a “carimbos” de 3×3, 4×4 ou mais pontos, ou em formatos variados como cunhas, segmentos de arco ou círculos, sempre com espaçamento ajustável entre os pontos e outras possibilidades de customização (Figura 2). Caracterizam-se por possibilitar pulsos de durações menores (10-20 ms) do que os pulsos tradicionais aplicados um a um (100 ms), assim proporcionando sessões mais rápidas e um tratamento mais previsível e com menos dor. Nesta modalidade de tratamento, as cicatrizes retinianas ficam menores e há menos dano colateral, mantendo-se a eficácia terapêutica, conforme a maioria dos estudos.9-11
A redução da quantidade de energia dissipada é consequência do método semiautomatizado, ou seria um ítem novo na frase? Fiquei em dúvida se o que vc quis dizer seria melhor colocarmos entre as traves, ou se ficaria melhor: “Métodos de aplicação semiautomatizados, redução da quantidade de energia dissipada (…), melhora das fibras … etc”
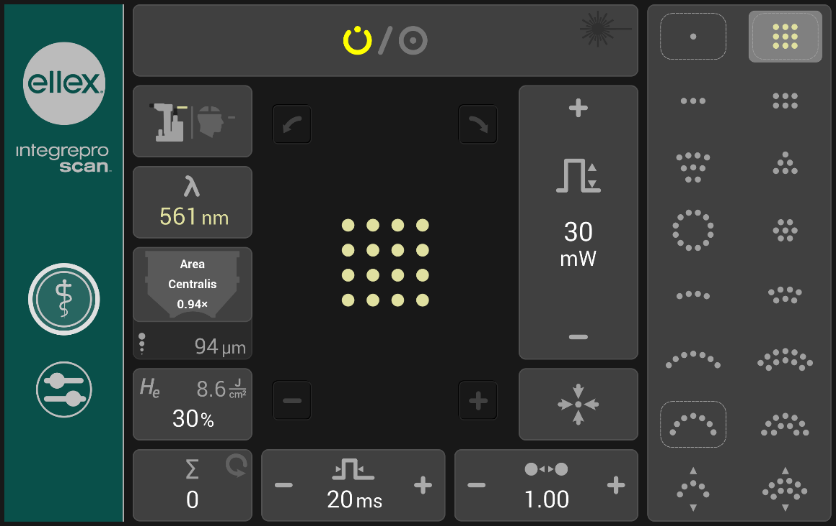
Fonte: https://www.ellex.com/treatments/photocoagulation-patternscanning/
“O essencial é invisível aos olhos”. Entendendo o princípio da fotoestimulação.
Outro mecanismo de ação associado ao laser térmico diz respeito ao estímulo sub-letal produzido nos tecidos adjacentes ao epicentro da lesão de fotocoagulação, particularmente no EPR. Inúmeros estudos conduzidos desde meados dos anos 90 investigaram os efeitos do laser sublimiar ou micropulsado na ativação de sistemas de reparo celular (heat shock proteins, ou proteínas de choque térmico, em especial a HSP70) e mudança na transcrição gênica de fatores antinflamatórios e anti-angiogênicos.12 Esses mecanismos foram e continuam bastante explorados em estratégias de laser sublimiar (às vezes chamado de fotoestimulação) para tratamento de edema macular e fluido sub-retiniano em diversas doenças. Estas modalidades de laser podem ser utilizadas com as seguintes finalidades:13-15
- como tratamento alternativo ao laser de mácula convencional em casos de edema macular secundário a Diabetes ou oclusões venosas, apresentando maior segurança pelo fato de não produzir cicatrizes
- como adjuvante ao tratamento farmacológico com injeções intravítreas de anti-angiogênicos ou corticoides, com o intuito de diminuir a necessidade de aplicações frequentes
- como tratamento principal em casos de coriorretinopatia serosa central com pontos de vazamento muito próximos à fóvea ou casos crônicos com vazamento de padrão indeterminado, onde todos os outros tratamentos se mostram ineficazes ou indisponíveis
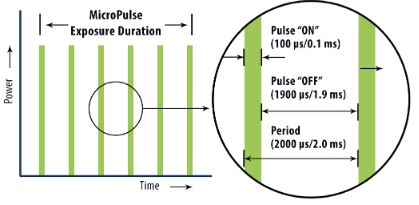
Fonte: https://www.iridex.com/MicroPulse.aspx
REFERÊNCIAS
1. Gould, R. Gordon (1959). “The LASER, Light Amplification by Stimulated Emission of Radiation”. In: Franken PA and Sands RH. (Eds.). The Ann Arbor Conference on Optical Pumping, the University of Michigan, 15 June through 18 June 1959. p. 128
2. Chew EY, Ferris FL 3rd. Nonproliferative diabetic retinopathy. In: Ryan SJ, Hinton DR, Schachat AP, Wilkinson CP, editors. Retina. 4th ed. Philadelphia: Elsevier Mosby; 2006:1271-84.
3. Photocoagulation treatment of proliferative diabetic retinopathy. Clinical application of Diabetic Retinopathy Study (DRS) findings, DRS report number 8. The Diabetic Retinopathy Study Research Group. Ophthalmology 1981 Jul;88(7):583-600.
4. Treatment techniques and clinical guidelines for photocoagulation of diabetic macular edema. Early Treatment Diabetic Retinopathy Study report number 2. Early Treatment Diabetic Retinopathy Study Research Group. Ophthalmology. 1987 Jul;94(7):761-74.
5. Hutton DW, Stein JD, Bressler NM, et al; Diabetic Retinopathy Clinical Research Network. Cost-effectiveness of intravitreal ranibizumab compared with panretinal photocoagulation for proliferative diabetic retinopathy: Secondary analysis from a Diabetic Retinopathy Clinical Research Network randomized clinical trial. JAMA Ophthalmol. 2017 Jun,135(6):576-84.
6. Lin J, Chang JS, Smiddy WE. Cost evaluation of panretinal photocoagulation versus intravitreal ranibizumab for proliferative diabetic retinopathy. Ophthalmology. 2016 Sep,123(9):1912-8.
7. Blumenkranz MS, Yellachich D, Andersen DE, et al. Semiautomated patterned scanning laser for retinal photocoagulation. Retina. 2006 Mar;26(3):370-6.
8. Sanghvi C, McLauchlan R, Delgado C, et al. Initial experience with the Pascal photocoagulator: a pilot study of 75 procedures. Br J Ophthalmol. 2008 Aug;92(8):1061-4.
9. Palanker D, Lavinsky D, Blumenkranz MS, et al. The impact of pulse duration and burn grade on size of retinal photocoagulation lesion: Implications for pattern density. Retina. 2011 Sep;31(8):1664-9.
10. Muqit MM, Marcellino GR, Gray JC, et al. Pain responses of Pascal 20 ms multi-spot and 100 ms single-spot panretinal photocoagulation: Manchester Pascal Study, MAPASS report 2. Br J Ophthalmol. 2010 Nov;94(11):1493-8.
11. Passos RM, Belucio-Neto J, Xavier CO, et al. Comparison of 577-nm multispot and standard single-spot photocoagulation for diabetic retinopathy. Ophthalmologica. 2019;241(4):202-10.
12. Inagaki K, Shuo T, Katakura K, et al. Sublethal phototermal stimulation with a micropulse laser induce heat shock protein expression in ARPE-19 cells. J Ophthalmol. 2015;2015:729792.
13. Luttrull JK, Dorin G. Subthreshold diode micropulse laser photocoagulation (SDM) as invisible retinal phototherapy for diabetic macular edema: a review. Curr Diabetes Rev. 2012;8(4):274-84
14. Passos RM, Malerbi FK, Rocha M, et al. Real-life outcomes of subthreshold laser therapy for diabetic macular edema. Int J Retina Vitreous. 2021 Jan;7(1):4.
15. Luttrull JK. LOW-INTENSITY/HIGH-DENSITY SUBTHRESHOLD DIODE MICROPULSE LASER FOR CENTRAL SEROUS CHORIORETINOPATHY. Retina. 2016;36(9):1658‐63.

